ニューロン、または構造および機能単位 神経系 「サイレント」それ自体は何も意味しません。 そして、ニューロンのコレクションでさえ、彼らが忙しくするまでは意味がありません。 最も重要なこと -神経インパルスの生成と伝導。 神経の衝動は私たちが存在することによる現象です。 胃液の分泌から随意運動までの生理学的作用は、刺激によって神経系によって調節されています。 最高 神経質な活動 脳も大脳皮質からの衝動の集まりです。
神経インパルスは神経プロセスの膜の電位の急速な変化であり、それはしばしば長距離にわたって伝達されなければならないため、インパルスは電気ワイヤーのアナログに過ぎない神経線維に沿って運ばれます。 たとえば、腰部下部にある脊髄前角のニューロンの軸索は腰神経叢を形成し、そこから最長の枝である坐骨神経が形成されます。 これの一部として、神経軸索は末梢に行き、腓骨神経の枝で終わります。そこには、例えば、親指の伸展が依存します。
そして、これらの軸索はどこにも中断されておらず、脊髄の前角から足の筋肉のシナプスまで、私たちの体で最も長い神経を形成する神経突起の密な束があります。 その中のパルス速度は120 m / sに達します。 したがって、人体の軸索を考慮に入れると、神経細胞の長さは1メートルを超える長さに達する可能性があります。 身体の「湿度の高い環境」で電気インパルスを失わずに保存および伝導し、必要な場所にそれを配信するにはどうすればよいですか? これには、ミエリン、ミエリンという特別な物質があります。 ミエリン鞘 神経線維 それは電線の絶縁に過ぎず、それがなければ、神経インパルスは「火花」を発し、変質し、またはまったく伝導されません。 神経のミエリン鞘は人体にどのように配置されていますか?それらの破壊は何につながりますか?
ミエリンは神経系で機能します
中枢神経系のニューロンに加えて、ニューロンを助け、それらに役立つグリア細胞があり、サポートおよび栄養機能を果たすことが知られています。 中枢神経系では、オリゴデンドロサイトが神経線維の「分離」の役割を果たし、末梢神経系では、ミエリン物質を形成するシュワン細胞を果たします。
太い神経を切ると、個々の神経束からなるケーブルと比較できます。 神経束は、ニューロンが1つだけの非常に薄いプロセスになるまで分割できます。 そして、すべての細胞のすべての軸索はミエリン鞘によって保護されています。 ミエリン線維は神経線維の周りにしっかりと巻き付けられており、実質的に隙間はありません。 鉛筆が中央に貼られた円筒形のトイレットペーパーのようです。 紙はかなり荒くなりますが、ミエリン層を模倣するために真実です。

レースと迎撃について
既知のように、電流は、理想的な導体、例えば、金属または超伝導条件下で電子の電流になると、光の速度で伝播します。 しかし、ニューロンでインパルスを伝導するプロセスは、電気化学と呼ばれます。 したがって、メンブレンを「再充電」するのに非常に短い時間で有限の時間がかかります。 これは、ミエリンタンパク質が存在する特定の領域で発生します。
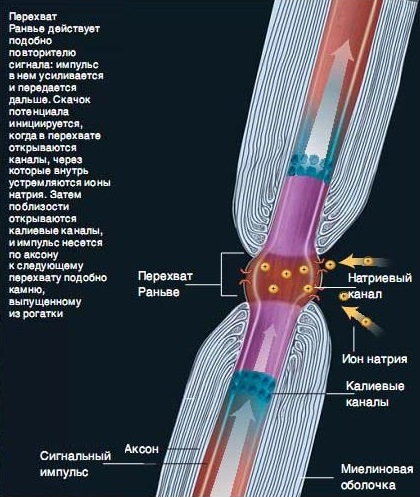
その後、ミエリン鞘が遮断されている神経に「ボトルネック」があります。 このエリアはランビエの迎撃と呼ばれています。 それらは1-2 mmの距離にあり、それらの間に神経に「ねじ込まれた」ミエリン鞘があります。 したがって、電流は遮断から遮断へと「ジャンプ」します。 遮断は電位を「遮断」し、導体の反対側に蓄積します。 シェルが厚いほど、インパルス伝導機能はより完璧になります。.
ミエリンに乏しい繊維があり、一般に、ミエリンを欠く軸索では、インパルスの速度がわずか1〜2 m /秒、つまり100倍遅い。 それらは自律神経系に見られ、インパルスの速度の増加はあまり重要ではありませんが、例えば、血管運動-栄養反応の神経支配では、ゆっくりとした詳細な作業が必要です。 絶縁体-ミエリン間で「ジャンプ」することなく、インパルスの継続的な伝導があるのは、このような領域です。
それは何で構成されていますか?
ミエリンのこの驚くべき生物学的絶縁機能は、その構造によって可能になりました。 ミエリンがニューロンの周りに巻かれた絶縁体の層であるとは思わないでください。 自然界ではすべてが細胞で構成されており、末梢神経のミエリンは増殖したシュワン細胞であり、その細胞質をニューロンの軸円柱に数回巻き付けていることを思い出してください。 与えるのはミエリンです 白色 神経線維、したがって「脳の白質」の概念。 これらは、ミエリンを多く含む神経線維の束にすぎません。 彼らの機能は、現在の指揮者になることです。 ブリッジ、脳幹、中脳-これらはすべて、想像を超えるほどの数の伝導束からなる領域です。
したがって、ミエリンは ほとんどの場合、水をはじく脂質から、そしてタンパク質から。 ミエリンの脂質は約75%で、これはほとんどの膜よりもはるかに高い... これがなぜ起こっているのかは明らかです。 結局のところ、二脂質層からなる膜は、境界を定めるだけではありません 内部環境 細胞。 それ 複雑なシステム キャリアタンパク質の助けを借りて発生する輸送。 神経のミエリン「ラップ」に関しては、それらのタスクは非常に単純です-神経線維をできるだけ分離することです。 それがミエリンがとても「脂肪」である理由です。 ランビエ遮断の領域では、イオンはニューロンの細胞質に入り、膜の脱分極を引き起こしますが、ミエリン領域ではできません。 これにより、パルスの中断のない通過が保証されます。

しかし、ミエリンが分解し始める状況があります。 このプロセスは脱髄と呼ばれ、同じ名前の病気のグループ全体によって現れます。 なぜこれが起こっているのですか?それはどのように現れますか?
脱髄とその症状
神経線維の有髄化の欠陥は、脱髄と呼ばれます。 これは、遺伝的欠陥が原因である可能性があります(これは脊髄症と呼ばれます)。 時々ミエリンは正常に合成されますが、ミエリンの生理学的回復はゆっくりと、または損傷を伴って起こります。 脱髄は、
ほとんどの場合、免疫炎症はミエリンの一次破壊のせいです。 神経の隔離は、サイトカイン、酵素、その他形質細胞やマクロファージによって合成された活性物質によって破壊されます。 抗ミエリン抗体は深刻な損傷を引き起こします。
最も よくある理由 脱髄は以下のプロセスです:
- 中毒(アルコール依存症、放射線、 高いレベル 糖尿病におけるグルコース);
- 脳血管疾患、脳卒中、アテローム性動脈硬化症;
- 血管炎および全身性膠原症;
- 自己免疫ワクチン接種後および感染後の反応。
最も 既知の病気 このグループの多発性硬化症は、非常に多様な臨床症状(麻痺、麻痺、骨盤臓器の機能不全、振戦、眼筋麻痺、反射の衰退、運動の協調障害)で発生する可能性があります。 多発性硬化症では、症状は焦点がどこにあるかと脱髄の重症度によって異なります。

脱髄はまた行動から来ます 物理的要因... 行動規則に従わない場合、多発性硬化症の非常に深刻な悪化が偶然に得られる可能性があります。 ミエリンが熱処理によって破壊されることは長い間確立されています。 したがって、患者は厳しく禁止されています:
- スチームバスに入る;
- 熱いお風呂とシャワーを浴びてください。
- 日光浴し、露出した体の部分で日光浴をします。
また、深刻な悪化は、急性呼吸器ウイルス感染、インフルエンザ、および発熱症候群で発生する他の疾患の後に発生します。 多発性硬化症および類似の疾患における体温の上昇は、ミエリンの分解を刺激します。
髄鞘再形成と治療の原則について
崩壊とともに、ニューロンのミエリン鞘は絶えず回復しています。 原則として、このミエリン化の過程は、古い病変が消え、新しい病変が現れるときの多発性硬化症の発症に特徴的です。 その後、ミエリン鞘修復機能が低下し、これは多発性硬化症の慢性病巣に典型的です。
神経と経路のミエリン鞘の修復は、2つの要因に依存します。
- ミエリンの供給源になり得る希突起膠細胞の存在;
- 神経変性の重症度、すなわち裸の軸索への損傷とそれらの機能の障害の程度
しかし、自己免疫病変の背景に対する髄鞘再形成の見通しは、実際にはそれほど明るくありません。 グリア細胞の再生能力は異常であり、新しく形成されたミエリンは破壊されたものと同じではないと考えられています。 そして、これはプロセスの同期と鈍い症状の出現につながります。 しかし、ミエリンが理論的にも回復することができれば、免疫炎症を抑制することによってその質を改善することは可能でしょうか?
原則として、これは多発性硬化症の最新の治療法の基礎となるものです。 不完全でも存在しますが、ミエリンは障害のさらなる進行と新しい症状の出現を防ぎます。 したがって、治療にはMITRSグループの薬剤(多発性硬化症の経過を変える薬剤)が使用されます。 これらには、ミエリンを形成する主要タンパク質の合成類似体であるコパキソンまたは酢酸グラチラマーと同様に、インターフェロンが含まれます。
神経インパルス伝導を回復し、病気の進行を遅らせる方法は? このため、パルス療法は免疫反応を抑制するメチルプレドニゾロンで使用されます。 場合によっては、例えばシクロホスファミドなどの細胞増殖抑制剤の注入が必要です。 現在臨床診療に導入されている 新しいクラス 高価だが効果的な薬物-分子的および遺伝子工学的手法を用いて製造される組換えモノクローナル抗体。
そのような薬の1つは、タイサブリまたはナタリズマブです。 白血球の膜にある特定のタンパク質に結合し、毛細血管から自己免疫炎症の中心への移動を防ぎます。 これにより、炎症反応の重症度が軽減され、炎症に対するミエリンの耐性が高まります。
したがって、モノクローナル抗体は、脱髄の新しい病巣の出現を防ぎ、既存の病巣の進行を止めることができます。 唯一の重大な欠点は、薬のコストです。 したがって、1回の静脈内注入のコストは2016年末に10万ルーブルに近づいており、少なくとも3回は毎月繰り返す必要があります。 多発性硬化症の患者の最大障害許容量が11,000ルーブル(最初のグループの障害者の場合)であることを考慮すると、ほとんどの患者にとって使用の問題 現代の意味 治療は非常に苦痛のままです。
結論として、神経系の回復能力は研究されていないということです。 特に、多くはセルラーテクノロジーを使用して実行でき、この方向への取り組みは常に進行中です。 幹細胞が本格的な神経組織に変身し、脳卒中後に失われた機能を回復できることを考えると、ミエリンの完全な回復などのプロセスも可能になると期待されています。
脱髄脱髄は、神経線維周囲のミエリン鞘への選択的損傷によって引き起こされる病気です
脱髄 -有髄神経線維が絶縁ミエリン層を失う病理学的プロセス。 ミクログリアとマクロファージによって貪食され、続いて星状細胞によってミエリンが貪食されて、線維性組織(プラーク)に置き換わります。 脱髄は、脳と脊髄の白質経路に沿ったインパルス伝導を混乱させます。 末梢神経は影響を受けません。
脱髄-炎症、虚血、外傷、毒性代謝またはその他の障害の結果としての神経線維のミエリン鞘の破壊。
脱髄(脱髄)-中枢または末梢神経系の神経線維の周りを走るミエリン鞘への選択的損傷によって引き起こされる疾患。 これは、順番に、ミエリン神経線維の機能不全につながります。 脱髄は原発性(多発性硬化症など)の場合と、頭蓋骨の損傷後に発症する場合があります。
脱髄疾患
主な症状の1つであるミエリンの破壊である疾患は、臨床医学、特に神経学の最も差し迫った問題の1つです。 に 去年 ミエリンの損傷を伴う疾患の症例数は明らかに増加しています。
ミエリン -中枢(CNS)および末梢神経系(PNS)の神経細胞、主に軸索のプロセスを囲む特殊なタイプの細胞膜。
ミエリンの主な機能:
軸索栄養
神経インパルス伝導の分離と加速
支援
バリア機能。
沿って 化学成分 ミエリンタンパク質の単分子層の間に位置する生体分子脂質層からなるリポタンパク質膜であり、神経線維の節間セグメントの周りにらせん状にねじれています。
ミエリン脂質は、リン脂質、糖脂質、ステロイドに代表されます。 これらの脂質はすべて単一の計画に従って構築され、必然的に疎水性成分(「尾」)と親水性基(「頭」)を持っています。
タンパク質はミエリンの乾燥重量の最大20%を占めます。 それらは2つのタイプがあります:表面にあるタンパク質と脂質層に浸されているか、膜を透過しているタンパク質です。 合計で、29以上のミエリンタンパク質が報告されています。 ミエリン塩基性タンパク質(MBP)、プロテオリピドタンパク質(PLP)、ミエリン関連グリコプロチン(MAG)は、タンパク質の質量の80%を占めます。 それらは構造的、安定化、輸送機能を実行し、免疫原性および脳炎誘発性の特性を示しています。 小さなミエリンタンパク質の中で、ミエリンオリゴデンドロサイト糖タンパク質(MOG)とミエリン酵素があり、 非常に重要 ミエリンの構造的および機能的関係を維持する上で。
CNSとPNSのミエリンは化学組成が異なります
PNSでは、ミエリンはシュワン細胞によって合成され、いくつかの細胞が1つの軸索のためにミエリンを合成しています。 1つのシュワン細胞は、ミエリンのない領域間の1つのセグメントのみでミエリンを生成します(ランビエ遮断)。 PNSのミエリンは中枢神経系のミエリンよりも著しく厚い。 すべての末梢神経と脳神経にはこのようなミエリンがあり、脳神経と脊髄根の短い近位セグメントのみがCNSミエリンを含んでいます。 視神経および嗅覚神経は主に中枢ミエリンを含む
中枢神経系では、ミエリンはオリゴデンドロサイトによって合成され、1つの細胞がいくつかの線維のミエリン化に関与しています。
ミエリン分解は、損傷に対する神経組織の反応の普遍的なメカニズムです。
ミエリン病は2つの主要なグループに分類されます
ミエリン症-ミエリンの構造における生化学的欠陥に関連し、通常は遺伝的に決定されます
ミエリンクラスティック-ミエリンクラスティック(または脱髄)疾患は、外的および内的の両方のさまざまな影響の影響下で通常合成されるミエリンの破壊に基づいています。
これら2つのグループへの分類は非常に条件付きです。なぜなら、ミエリン症の最初の臨床症状はさまざまな症状に関連している可能性があるからです。 外部要因、および脊髄破砕薬は、おそらく素因のある個人で発生します。
ミエリン疾患のグループ全体で最も一般的な疾患は多発性硬化症です。 鑑別診断が最も頻繁に行われなければならないのはこの疾患です。
遺伝性脊髄症
これらの疾患のほとんどの臨床症状は、すでにより頻繁に指摘されています 子供時代... 同時に、後年に始まる可能性のある多くの病気があります。
副腎白質ジストロフィー(ALD) 副腎皮質の機能不全に関連し、中枢神経系とPNSの両方のさまざまな部分の活発なびまん性脱髄を特徴としています。 ALDの主な遺伝的欠陥は、X染色体上の遺伝子座-Xq28に関連しています。その遺伝子産物(ALD-Pタンパク質)は、ペルオキシソーム膜タンパク質です。 継承タイプ 典型的なケース -劣性、性別依存。 これまでに、ALDのさまざまな臨床変異に関連するさまざまな遺伝子座で20を超える変異が報告されています。
この疾患の主な代謝欠陥は、組織の飽和脂肪酸の含有量の増加です 長い鎖 (特にS-26)、これはミエリンの構造と機能の重大な違反につながります。 疾患の病因における退行過程に加えて、腫瘍壊死因子アルファ(TNF-a)の産生増加に関連する脳組織の慢性炎症が不可欠です。 ALD表現型は、この活動によって決定されます 炎症過程 X染色体上の変異の異なるセットと、欠陥のある遺伝子産物の影響の常染色体の改変の両方が原因である可能性が高いです。 性X染色体の主な遺伝的欠陥と他の染色体の特異な遺伝子セットの組み合わせ。
オリゴデンドロサイトとシュワン細胞は、軸索の周りにミエリン鞘を形成します(神経細胞突起)。 ミエリン鞘は、神経が信号を送信するのに役立ちます。 神経のミエリン鞘は、70-75%の脂質と25-30%のタンパク質です。 だから、ここではミエリン鞘の回復と再生をサポートするだけでなく、硬化症を防ぐのに役立つ治療法があります。
1.葉酸とビタミンB12の栄養補助食品を摂取します。 身体は、神経系を保護し、有能にミエリン鞘を「修復」するためにこれら2つの物質を必要とします。 5.コリン(ビタミンD)とイノシトール(イノシトール; B8)を多く含む食品を食べる。 これらのアミノ酸は、ミエリン鞘の修復に重要です。
6. Bビタミンが豊富な食品を食べるビタミンB-1、チアミンとも呼ばれ、B-12はミエリン鞘の物理的成分です。
それが損傷すると、記憶の問題が発生し、多くの場合、特定の動きや機能障害が発生します。 葉酸とB12はどちらもミエリンの分解を防ぎ、ミエリンの損傷を再生するのに役立ちます。 コリンは卵、牛肉、豆、一部のナッツに含まれています。
解剖学的には、それらの中で、脳の神経膠細胞(オリゴデンドロサイトとアストロサイト)と末梢神経系のシュワン細胞が区別されます。
ナッツ、野菜、バナナにはイノシトールが含まれています。 7.銅を含む食品も必要です。 脂質は、銅依存性酵素を使用してのみ作成できます。 銅は、レンズ豆、アーモンド、カボチャの種、ゴマ、セミチョコレートに含まれています。 神経系の主な機能要素は神経細胞またはニューロンであり、10〜15%を占めます 合計 神経系の細胞要素。
神経組織の大部分を構成するグリア要素は、補助機能を実行し、ニューロン間のほぼすべての空間を満たします。 ミエリンの主な機能は、代謝の隔離と神経インパルス伝導の加速、サポートとバリア機能です。
ミエリン破壊に関連する神経疾患は、ミエリン症とミエリンクラスティックの2つの主要なグループに分類できます。 ミエリン破砕性疾患は、外的および内的の両方のさまざまな影響の影響下で、通常合成されたミエリンの破壊に基づいています。
白質ジストロフィー群は、脳の白質のびまん性線維性変性を伴う脱髄および脳組織におけるグロボイド細胞の形成を特徴とする。 脊髄破砕性疾患の中で 特別な注意 ミエリンの破壊が重要な役割を果たす病因において、ウイルス感染に値する。
すべての治療 ウイルス感染 感染細胞でのウイルスの増殖を止める抗ウイルス薬の使用に基づく。 化学療法と放射線療法の後、多発性壊死と組み合わせた限局性脱髄を伴う中毒性白質脳症が発症することがあります。 これらの疾患の病因において、ミエリン抗原に対する自己免疫応答、希突起膠細胞への損傷、およびその結果、再ミエリン化プロセスの破壊が不可欠です。
レシチンを含む製品の使用は優れた予防策であり、神経系の活動障害に関連する疾患を治療する方法の1つです。
この疾患では、脱灰の大きな病巣が主に前頭葉の白質に形成され、時には灰白質の関与も伴います。 病変は、オリゴデンドロサイトの顕著な初期病変を伴う、完全および部分的な脱髄の交互の領域からなる。 ミエリンの破壊とその成分への自己免疫反応の発達は、中枢神経系の多くの血管および腫瘍随伴過程で観察されます(E.I. Gusev、A.N。Boyko。
自己免疫プロセスは、ミエリン毒性抗体とキラーTリンパ球の出現を伴い、シュワン細胞とミエリンを破壊します。 免疫系を修正するために、免疫系の活性を低下させる免疫抑制剤、および免疫系の成分の比率を変化させる免疫調節剤が使用されます。
体内に慢性炎症または自己免疫疾患の原因が存在する場合、神経のミエリン鞘の完全性が破壊されます。 特定の自己免疫疾患と外因性 化学的要因食品中の農薬などは、ミエリン鞘を損傷する可能性があります。 著者に知られている出所はどれも、神経線維の損傷したミエリン鞘を修復するための硫酸ステファグラブリンの特性について言及していません。
ミエリン鞘
ミエリン (一部のエディションでは、正しくない形式が使用されています ミエリン)形成する物質である ミエリン鞘 神経線維。
ミエリン鞘 -多くのニューロンの軸索を覆う電気絶縁シース。 ミエリン鞘はグリア細胞によって形成されます:末梢神経系では-シュワン細胞、中枢神経系では-オリゴデンドロサイト。 ミエリン鞘は、グリア細胞の体の平らな伸長から形成され、軸索を絶縁テープのように繰り返し包みます。 実質的に細胞外成長には細胞質はなく、その結果、ミエリン鞘は実際には細胞膜の多くの層です。 孤立したエリア間のギャップはランビエインターセプトと呼ばれます。
上記から、 ミエリン そして ミエリン鞘 同義です。 通常用語 ミエリン 生化学で一般的にその分子組織に言及するときに使用され、 ミエリン鞘 -形態学および生理学において。
生成されるミエリンの化学組成と構造 他の種類 グリア細胞は異なります。 有髄ニューロンの色は白なので、脳の「白質」という名前です。
ミエリンの約70〜75%は脂質、25〜30%はタンパク質で構成されています。 この高い脂質含有量は、ミエリンを他の生体膜と区別します。
ミエリンの分子組織
ミエリンのユニークな特徴は、軸索の周りのグリア細胞のプロセスがらせん状に絡み合って形成されるため、膜の2つの層の間に細胞質が実質的に存在しないことです。 ミエリンはこの二重膜です。つまり、脂質二重層とそれに関連するタンパク質で構成されています。
ミエリンタンパク質の中で、いわゆる内部および外部タンパク質が区別されます。 内側のものは膜に統合されており、外側のものは表面的に位置\u200b\u200bしているため、膜への接続は少ないです。 ミエリンは糖タンパク質と糖脂質も含んでいます。
タンパク質は、哺乳類の中枢神経系のニューロンのミエリン鞘の乾物塊の25〜30%を占めます。 脂質は乾燥重量の約70〜75%を占めます。 脊髄のミエリンでは、脂質の割合が脳のミエリンよりも高くなっています。 ほとんどの脂質はリン脂質(43%)で、残りはコレステロールとガラクト脂質でほぼ同じ割合です。
軸索の髄鞘形成
ミエリン鞘の形成と中枢神経系と末梢神経系のミエリンの構造には違いがあります。
中枢神経系の髄鞘形成
末梢神経系の髄鞘形成
シュワン細胞から供給。 各シュワン細胞は、らせん状のミエリンプレートを形成し、個々の軸索のミエリン鞘の個別のセクションにのみ関与します。 シュワン細胞の細胞質は、ミエリン鞘の内面と外面にのみ残っています。 ランビエの遮断はまた、中枢神経系よりも狭い隔離細胞の間にも残っています。
いわゆる「無髄」繊維はまだ分離されていますが、わずかに異なるスキームに従っています。 いくつかの軸索は、完全にそれらの周りを閉じない絶縁ケージに部分的に埋め込まれています。
も参照
- シュワン細胞
リンク集
- 「ミエリンの主なタンパク質」-定期的な「医療化学の質問」の記事№6 2000
ウィキメディア財団。 2010。
カリフォルニア大学サンフランシスコ校の科学者たちは、多発性硬化症のマウスで失われたミエリンを回復させる一連の実験に成功しています。 ミエリンの再生は健康なニューロンを保護するだけでなく、損傷した神経細胞が機能するように戻ることも可能にすることが示されています。 これについては科学雑誌で見つけることができますeLife.
多発性硬化症などの疾患の中心には、自身の免疫細胞によるニューロンの膜の「攻撃」があります。 このため、ニューロンが神経インパルスを伝達する能力は失われます。 ニューロンの長いプロセスをカバーするミエリン層 この場合 神経インパルスが「走る」「ワイヤー」として機能します。 その破壊はインパルスの通過を5-10倍遅くし、失明、感度障害、麻痺、認知障害およびその他の神経学的問題を引き起こします。
科学者は、マウスの多発性硬化症のモデルを使用しました。このモデルでは、健康なマウスにミエリン鞘に含まれるタンパク質が注射され、体の自己免疫反応が開始されます。 新しい実験は、同じ科学者グループがオリゴデンドロサイト(脳のグリア「ヘルパー」細胞)からのミエリン修復を助けるムスカリン受容体のクラスターを発見した以前の研究に基づいています。 また、「クレマスチン」と呼ばれるヒスタミン遮断薬を服用した場合の視神経浮腫患者のプラスの影響も考慮に入れました。
に 現在の仕事 研究者らは、マウスで多発性硬化症を引き起こすタンパク質と一緒にクレマスチンを使用し、脊髄および脳のニューロンの軸索のミエリン鞘が回復したため、これらの動物が疾患の症状を大幅に軽減することを示しました。
クレマスチンおよび比較群を注射したマウスの脊髄の脱髄領域。 緑で オリゴデンドロサイトが示されています、赤-T細胞、マクロファージおよびミクログリア。 出典:Chan et al./eLife
研究における「つまずきの石」は、クレマスチンが同時に作用するということでした 他の種類 したがって、科学者はオリゴデンドロサイトに対するクレマスチンの効果と多発性硬化症の症状の弱体化との関係を証明する必要がありました。 これを行うために、マウスの受容体を1つずつ「オフ」にし、薬物の効果を観察しました。 その結果、クレマスチンの標的として働き、前駆細胞からのオリゴデンドロサイトの発達を遅らせるタイプ1ムスカリン受容体が発見されました。
その後、最も興味深いことが起こりました。 この受容体の遺伝子をオフにする試みは、多発性硬化症の影響を受けたニューロンがその機能を回復し始めたという事実につながりました。 したがって、科学者たちはオリゴデンドロサイトのM1受容体がニューロンの再ミエリン化の影響を遅くすることを示しました。 残念ながら この瞬間 M1受容体を選択的に遮断する物質はありませんが、カリフォルニアの研究者たちは、それを動物で、そしておそらく人間でも作成してテストするつもりであると言いました。
「炎症の期間中に新しいミエリンの回復プロセスと安定性をトリガーすることが可能であることを私たちは今示しました。 将来的に髄鞘再形成に焦点を合わせると、失われた機能の回復に役立つだけでなく、生活の質も改善することをMS患者に伝えることができます。
テキスト:Victoria Zyulina
炎症性脱髄中の再ミエリン化の促進は、軸索の喪失を防ぎ、機能回復を改善します。 eLifeで。 2016年9月オンライン公開
